Prionen
Tödliche Proteine
Krank machende Erreger wie Bakterien und Pilze sind weitgehend bekannt. Doch auch einfache körpereigene Proteine können schreckliche Krankheiten auslösen. Diese Prionen sind unter anderem für BSE und die Creutzfeldt-Jakob-Krankheit verantwortlich.
Sie sind keine Bakterien, keine Viren, keine Parasiten, können aber trotzdem krank machen: Prionen sind tierische Proteine, die erst 1997 entdeckt wurden. Das Wort «Prion» leitet sich aus den beiden Worten «Protein» und «Infektion» ab, auch wenn es sich nicht um ein Lebewesen handelt, sondern um ein sogenanntes organisches Gift mit infektiösen Eigenschaften.
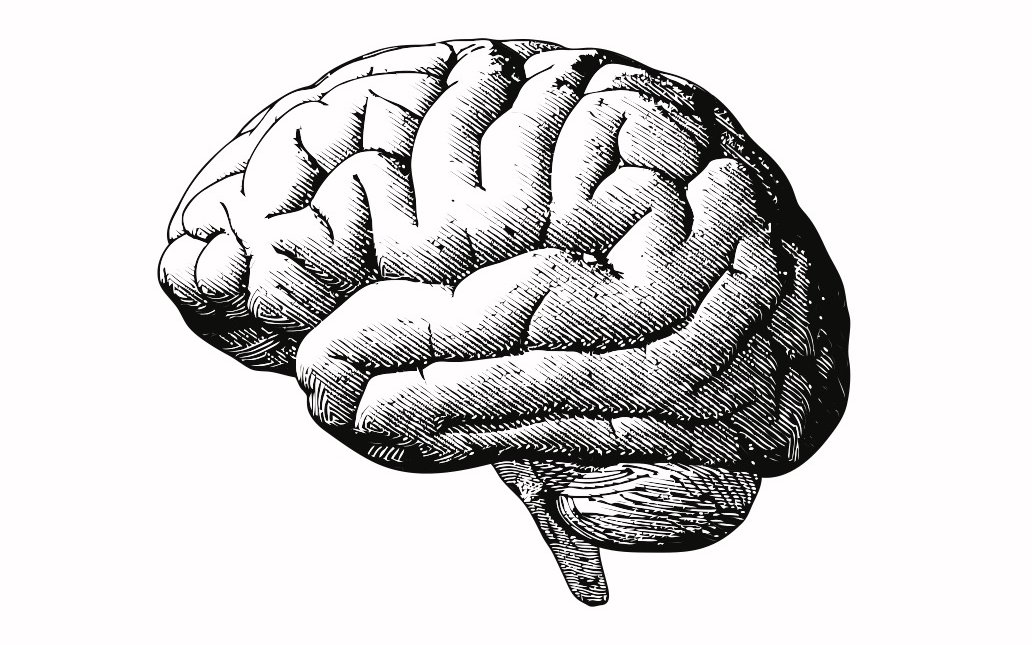
Aber erst mal sind Prionen nichts anderes als körpereigene Eiweisse. Sie setzen sich wie andere Proteine aus Aminosäuren zusammen und sind auf charakteristische Art und Weise gefaltet. Die Art der Faltung ist massgebend für die Funktion der Eiweisse im Körper. Prionen finden sich vor allem im Nervensystem, speziell im Gehirn. Dort sitzen sie auf den Zelloberflächen und schützen die Zelle vor schädlichen Stoffen. Manche Prion-Strukturen sind jedoch anders gefaltet als diese «normalen» Prionen, ändern damit ihre Funktion und können so schwerwiegende Krankheiten auslösen. Zu den bekanntesten gehören BSE (Bovine spongiforme…
Möchten Sie diesen Artikel lesen?
Lesedauer: 3 MinutenHaben Sie bereits ein Konto?
Hier einloggen.
















Bitte loggen Sie sich ein, um die Kommentarfunktion zu nutzen.
Falls Sie noch kein Agrarmedien-Login besitzen:
Jetzt registrieren